MITOCHONDRIES ET MUSCLES
La santé cardiaque optimale d’un animal dépend de son état de santé général. Maintenir les chiens et les chats dans une condition physique idéale est essentiel à leur bien-être. Inclure un examen nutritionnel lors de chaque examen vétérinaire peut aider les personnes à atteindre cet objectif de santé pour leurs animaux de compagnie.
Pour une santé axée sur le cœur, la nutrition peut jouer un rôle clé dans le soutien de la fonction cardiaque.
Pour savoir comment des nutriments spécifiques peuvent avoir un impact positif sur la santé cardiaque, prenez le temps de lire les articles existants à ce sujet.
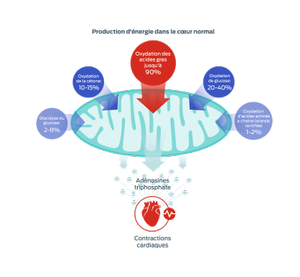
Adapté de Lopaschuk et al., 2010 & 2017
Acides gras
Ces nutriments sont le principal substrat utilisé par les mitochondries afin de générer de l’énergie pour le cœur, sous forme d’adénosine triphosphate (ATP).
Toutefois, les mitochondries sont également métaboliquement flexibles : elles peuvent utiliser différents substrats pour s’adapter à la disponibilité des nutriments, à l’évolution de la charge de travail cardiaque ou à la modification des conditions métaboliques. Le glucose, les cétones et les acides aminés à chaîne ramifiée (BCAA) représentent d’autres sources d’énergie.1–3

Triglycérides à chaîne moyenne (TCM)
Les TCM constituent une source d’acides gras à chaîne moyenne (AGCM). Avec des chaînes de carbone plus courtes, les AGCM ne nécessitent pas de transporteurs pour leur entrée dans les mitochondries. Avec moins d’étapes métaboliques impliquées, les AGCM sont plus rapidement oxydés en énergie.4
Des études ont également montré que les TCM peuvent réduire les espèces réactives mitochondriales et cytoplasmiques de l’oxygène, ce qui a un impact favorable sur la progression de la maladie cardiaque.5–8

Acides gras oméga 3
La recherche montre que les acides gras oméga-3 à longue chaîne, en particulier l’acide eicosapentaénoïque (EPA), présentent de nombreux avantages cardiaques : ils aident à réduire les médiateurs inflammatoires et le stress oxydatif à stabiliser les arythmies cardiaques chez les chiens, à réduire la pression artérielle et à réduire le remodelage cardiaque dans les maladies cardiaques.9–17
La cachexie cardiaque est fréquente chez les chiens souffrant d’insuffisance cardiaque congestive, et la perte de masse corporelle maigre est associée à des temps de survie nettement plus courts.18–19 Il semblerait que l’inflammation soir un facteur causal ou contributif de la cachexie. Ainsi, les oméga 3 peuvent présenter un autre avantage se traduisant par la diminution des effets indésirables de l’inflammation sur la masse corporelle maigre.20–22

Acides aminés : taurine, lysine et méthionine
La taurine est l’acide aminé le plus abondant dans le tissu cardiaque. Bien que son rôle exact ne soit pas encore connu, des études montrent que la taurine est importante pour maintenir la contractilité et l’homéostasie du muscle cardiaque.23–25 Chez les chats, la taurine est un acide aminé essentiel. Néanmoins, une carence en taurine peut entraîner une insuffisance myocardique chez les chiens et les chats.26
La lysine et la méthionine sont des précurseurs d’acides aminés pour la synthèse de la carnitine, un peptide qui aide à transporter les acides gras à longue chaîne dans les mitochondries pour la production d’ATP.27

Vitamine E
Les dérivés réactifs de l’oxygène (DRO) sont le résultat du métabolisme cellulaire. Cependant, si les DRO s’accumulent, le stress oxydatif augmente, ce qui entraîne des dommages à la membrane cellulaire et à l’ADN, ainsi qu’une dénaturation des protéines. Un excès de DRO peut également déclencher une cascade d’événements moléculaires contribuant aux maladies cardiaques. La vitamine E est un antioxydant cellulaire qui élimine les DRO et prévient les dommages causés par le stress oxydatif.
Dans des conditions de dysfonctionnement mitochondrial, qui contribue à l’insuffisance cardiaque, les niveaux de DRO augmentent, ce qui accroît le besoin d’antioxydants.28–32

Magnésium
Le magnésium joue plusieurs rôles dans le maintien d’une fonction cardiaque saine, y compris des actions antiarythmiques et antioxydantes. Dans les cellules cardiaques, ce minéral aide également à transporter l’ATP. Chez l’homme, des niveaux insuffisants de magnésium sont en corrélation avec une insuffisance cardiaque et un risque accru de troubles cardiovasculaires.33–36
La recherche chez Purina

Les cœurs vieillissants ne s’adaptent pas aussi bien aux maladies ou aux changements environnementaux que les cœurs plus jeunes. Des études ont montré que l’augmentation d’une cascade moléculaire particulière, appelée voie de signalisation Wnt/bêta-caténine, fait partie des nombreux changements associés au vieillissement accéléré.37–39
Les scientifiques de Purina ont exploité des données d’expression génique accessibles au public sur des cœurs vieillissants.40, 41
Cette approche algorithmique a révélé que quatre gènes pour la voie de signalisation Wnt étaient régulés à la baisse dans les cœurs plus âgés.
Cependant, une intervention alimentaire avec restriction calorique ou supplémentation avec du resvératrol antioxydant a permis de restaurer les expressions géniques aux niveaux observés dans les jeunes cœurs.42–43
Cette recherche a montré le rôle positif que pouvait jouer la nutrition sur le vieillissement cardiaque au niveau moléculaire. Ceci a conduit à des études explorant les moyens par lesquels des nutriments spécifiques pourraient soutenir ou améliorer la fonction cardiaque.
Points clés à retenir
- De nombreux nutriments présentent des avantages reconnus pour la santé cardiaque.
- Les acides gras sont la principale source d’ATP généré par les mitochondries cardiaques.
- L’étude algorithmique de Purina montre comment la nutrition peut avoir des effets positifs sur un cœur vieillissant.
Explorez les domaines de la transformation de la santé cardiaque :
En savoir plus
- Doenst, T., Nguyen, T. D., & Abel, E. D. (2013). Cardiac metabolism in heart failure: implications beyond ATP production. Circulation Research, 113(6), 709–724.
- Lopaschuk, G.D., Ussher, J.R., Folmes, C.D., Jaswal, J.S., & Stanley, W.C. (2010). Myocardial fatty acid metabolism in health and disease. Physiological Reviews, 90(1), 207–258.
- Lopaschuk, G. (2017). Metabolic Modulators in Heart Disease: Past, Present, and Future. Canadian Journal of Cardiology, 33, 838–849.
- Labarthe, F., Gélinas, R., & Des Rosiers, C. (2008). Medium-chain fatty acids as metabolic therapy in cardiac disease. Cardiovascular Drugs and Therapy, 22(2), 97–106.
- Bach, A.C., & Babayan, V.K. (1982). Medium-chain triglycerides: an update. American Journal of Clinical Nutrition, 36(5), 950–962.
- Finck, B. N., Han, X., Courtois, M., Aimond, F., Nerbonne, J. M., Kovacs, A., Gross, R. W., & Kelly, D. P. (2003). A critical role for PPARalpha-mediated lipotoxicity in the pathogenesis of diabetic cardiomyopathy: modulation by dietary fat content. Proceedings of the National Academy of Sciences of the United States of America, 100(3), 1226–1231.
- Labarthe, F., Khairallah, M., Bouchard, B., Stanley, W.C., & Des Rosiers, C. (2005). Fatty acid oxidation and its impact on response of spontaneously hypertensive rat hearts to an adrenergic stress: benefits of a medium-chain fatty acid. American Journal of Physiology-Heart and Circulatory Physiology, 288(3), H1425–36.
- Saifudeen, I., Subhadra, L., Konnottil, R., & Nair, R. R. (2017). Metabolic Modulation by Medium-Chain Triglycerides Reduces Oxidative Stress and Ameliorates CD36-Mediated Cardiac Remodeling in Spontaneously Hypertensive Rat in the Initial and Established Stages of Hypertrophy. Journal of Cardiac Failure, 23(3), 240–251.
- Bauer, J.E. (2006). Metabolic basis for the essential nature of fatty acids and the unique dietary fatty acid requirements of cats. Journal of the American Veterinary Medical Association, 229(11), 1729–1732.
- Billman, G.E., Kang, J.X., & Leaf, A. (1999). Prevention of sudden cardiac death by dietary pure omega-3 polyunsaturated fatty acids in dogs. Circulation
,99(18), 2452–2457. - Freeman, L.M., Rush, J.E., Kehayias, J.J., Ross, J.N. Jr, Meydani, S.N., Brown, D.J., … Roubenoff, R. (1998). Nutritional alterations and the effect of fish oil supplementation in dogs with heart failure. Journal of Veterinary Internal Medicine, 12(6), 440–448.
- Freeman, L.M. (2010). Beneficial effects of omega-3 fatty acids in cardiovascular disease. Journal of Small Animal Practice, 51(9), 462–470.
- Laurent, G., Moe, G., Hu, X., Holub, B., Leong-Poi, H., Trogadis, J., Connelly, K., Courtman, D., Strauss, B. H., & Dorian, P. (2008). Long chain n-3 polyunsaturated fatty acids reduce atrial vulnerability in a novel canine pacing model. Cardiovascular Research, 77(1), 89–97.
- London, B., Albert, C., Anderson, M. E., Giles, W. R., Van Wagoner, D. R., Balk, E., … Lathrop, D. A. (2007). Omega-3 fatty acids and cardiac arrhythmias: prior studies and recommendations for future research: a report from the National Heart, Lung, and Blood Institute and Office Of Dietary Supplements Omega-3 Fatty Acids and their Role in Cardiac Arrhythmogenesis Workshop. Circulation, 116(10), e320–e335.
- Smith, C.E., Freeman, L.M., Rush, J.E., Cunningham, S.M., & Biourge, V. (2007). Omega-3 fatty acids in Boxer dogs with arrhythmogenic right ventricular cardiomyopathy. Journal of Veterinary Internal Medicine, 21(2), 265–273.
- Wall, R., Ross, R. P., Fitzgerald, G. F., & Stanton, C. (2010). Fatty acids from fish: the anti-inflammatory potential of long-chain omega-3 fatty acids. Nutrition Reviews, 68(5), 280–289.
- Hansen, R. A., Ogilvie, G. K., Davenport, D. J., Gross, K. L., Walton, J. A., Richardson, K. L., Mallinckrodt, C. H., Hand, M. S., & Fettman, M. J. (1998). Duration of effects of dietary fish oil supplementation on serum eicosapentaenoic acid and docosahexaenoic acid concentrations in dogs. American Journal of Veterinary Research, 59(7), 864–868.
- Ineson, D. L., Freeman, L. M., & Rush, J. E. (2019). Clinical and laboratory findings and survival time associated with cardiac cachexia in dogs with congestive heart failure. Journal of Veterinary Internal Medicine, 33(5), 1902–1908.
- Freeman, L.M. (2012). Cachexia and sarcopenia: emerging syndromes of importance in dogs and cats. Journal of Veterinary Internal Medicine, 26(1), 3–17.
- Dupont, J., Dedeyne, L., Dalle, S., Koppo, K., & Gielen, E. (2019). The role of omega-3 in the prevention and treatment of sarcopenia. Aging Clinical and Experimental Research, 31(6), 825–836.
- Gorjao, R., Dos Santos, C., Serdan, T., Diniz, V., Alba-Loureiro, T. C., Cury-Boaventura, M. F., Hatanaka, E., Levada-Pires, A. C., Sato, F. T., Pithon-Curi, T. C., Fernandes, L. C., Curi, R., & Hirabara, S. M. (2019). New insights on the regulation of cancer cachexia by N-3 polyunsaturated fatty acids. Pharmacology & Therapeutics, 196, 117–134.
- Robinson, S. M., Reginster, J. Y., Rizzoli, R., Shaw, S. C., Kanis, J. A., Bautmans, I., … Cooper, C., & ESCEO working group (2018). Does nutrition play a role in the prevention and management of sarcopenia? Clinical Nutrition (Edinburgh, Scotland), 37(4), 1121–1132.
- Sanderson S. L. (2006). Taurine and carnitine in canine cardiomyopathy. The Veterinary Clinics of North America. Small Animal Practice, 36(6), 1325–viii.
- Schaffer, S., Solodushko, V., & Azuma, J. (2000). Taurine-deficient cardiomyopathy: role of phospholipids, calcium and osmotic stress. Advances in Experimental Medicine and Biology, 483, 57–69.
- Schaffer, S. W., Jong, C. J., Ramila, K. C., & Azuma, J. (2010). Physiological roles of taurine in heart and muscle. Journal of biomedical science, 17, Suppl 1(Suppl 1), S2.
- Pion, P.D., Kittleson, M.D., Rogers, Q.R., & Morris, J.G. (1987). Myocardial Failure in Cats Associated with Low Plasma Taurine: A Reversible Cardiomyopathy. Science, 237, 764–768.
- Wang, Z., Liu, Y., Liu, G., Lu, H., Mao, C. (2018). L-Carnitine and heart disease. Life Sciences, 184, 88-97.
- Birringer, M., & Lorkowski, S. (2019). Vitamin E: regulatory role of metabolites. International Union of Biochemistry and Molecular Biology, Life, 71(4), 479–486.
- Michałek, M., Tabiś, A., Cepiel, A., & Noszczyk-Nowak, A. (2020). Antioxidative enzyme activity and total antioxidant capacity in serum of dogs with degenerative mitral valve disease. Canadian Journal of Veterinary Research, 84(1), 67–73.
- Pryor, W. A. (2000). Vitamin E and heart disease: basic science to clinical intervention trials. Free radical biology & medicine, 28(1), 141–164.
- Sagols, E., & Priymenko, N. (2011). Oxidative stress in dog with heart failure: the role of dietary fatty acids and antioxidants. Veterinary Medicine International, 2011, 180–206.
- Sozen, E., Demirel, T., & Ozer, N.K. (2019). Vitamin E: regulatory role in the cardiovascular system. International Union of Biochemistry and Molecular Biology Life, 71(4), 507–515.
- Del Gobbo, L.C., Imamura, F., Wu, J.H., de Oliveira Otto, M.C., Chiuve, S.E., & Mozaffarian, D. (2013). Circulating and dietary magnesium and risk of cardiovascular disease: a systematic review and meta-analysis of prospective studies. American Journal of Clinical Nutrition, 98(1), 160–173.
- Freeman, L.M., Rush, J.E., & Markwell, P.J. (2006). Effects of dietary modification in dogs with early chronic valvular disease. Journal of Veterinary Internal Medicine, 20, 1116–1126.
- Qu, X., Jin, F., Hao, Y., Li, H., Tang, T., Wang, H., Yan, W., & Dai, K. (2013). Magnesium and the risk of cardiovascular events: a meta-analysis of prospective cohort studies. PloS one, 8(3), e57720.
- Tardy, A.L., Pouteau, E., Marquez, D., Yilmaz, C., & Scholey, A. (2020). Vitamins and Minerals for Energy, Fatigue and Cognition: A Narrative Review of the Biochemical and Clinical Evidence. Nutrients, 12(1). pii: E228.
- Brack, A. S., Conboy, M. J., Roy, S., Lee, M., Kuo, C. J., Keller, C., & Rando, T. A. (2007). Increased Wnt signaling during aging alters muscle stem cell fate and increases fibrosis. Science (New York, N.Y.), 317(5839), 807–810.
- Liu, H., Fergusson, M. M., Castilho, R. M., Liu, J., Cao, L., Chen, J., … Finkel, T. (2007). Augmented Wnt signaling in a mammalian model of accelerated aging. Science (New York, N.Y.), 317(5839), 803–806.
- Marchand, A., Atassi, F., Gaaya, A., Leprince, P., Le Feuvre, C., Soubrier, F., Lompré, A. M., & Nadaud, S. (2011). The Wnt/beta-catenin pathway is activated during advanced arterial aging in humans. Aging Cell, 10(2), 220–232.
- Li, Q., & Hannah, S. S. (2012). Wnt/β-catenin signaling is downregulated but restored by nutrition interventions in the aged heart in mice. Archives of Gerontology and Geriatrics, 55(3), 749–754.
- Barger, J. L., Kayo, T., Vann, J. M., Arias, E. B., Wang, J., Hacker, T. A., Wang, Y., Raederstorff, D., … Prolla, T. A. (2008). A low dose of dietary resveratrol partially mimics caloric restriction and retards aging parameters in mice. PloS one, 3(6), e2264.