MITOCONDRI E MUSCOLI
La salute ottimale del cuore dipende dallo stato di salute generale dell'animale. Mantenere cani e gatti in condizioni fisiche ideali è fondamentale per il loro benessere. L'aggiunta di una valutazione nutrizionale a ogni visita veterinaria può essere utile ai proprietari di animali domestici per raggiungere questo obiettivo di salute per i loro amici a quattro zampe.
Parlando di salute del cuore, la nutrizione può svolgere un ruolo importante a supporto della funzionalità cardiaca.
Leggi di più per scoprire in che modo nutrienti specifici possono influire positivamente sulla salute del cuore.
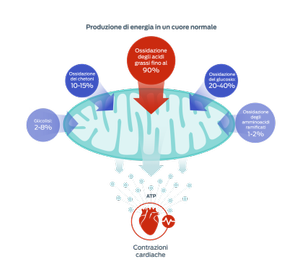
Adattato da Lopaschuk et al., 2010 e 2017
Acidi grassi
Questi nutrienti sono il primo substrato utilizzato dai mitocondri per produrre energia per il cuore, sotto forma di adenosina trifosfato (ATP).
Tuttavia, i mitocondri sono anche metabolicamente flessibili: sono infatti in grado di utilizzare altri substrati per adattarsi alla disponibilità di nutrienti, a carichi di lavoro cardiaci variabili o a condizioni metaboliche alterate. Altre fonti di energia includono glucosio, chetoni e amminoacidi a catena ramificata (BCAA).1-3

Trigliceridi a catena media (MCT)
I trigliceridi a catena media (MCT) costituiscono una fonte di acidi grassi a catena media (MCFA). Con catene di carbonio più corte, gli MCFA non richiedono trasportatori per essere assorbiti nei mitocondri. Grazie al minor numero di passaggi metabolici, gli MCFA vengono ossidati e trasformati in energia più rapidamente.4
Gli studi hanno inoltre dimostrato che gli MCT sono in grado di ridurre le specie reattive dell'ossigeno mitocondriale e citoplasmatico, producendo effetti che contrastano la progressione della cardiopatia.5-8

Acidi grassi omega-3
La ricerca dimostra che gli acidi grassi omega-3 a catena lunga, e in particolare l'acido eicosapentaenoico (EPA), offrono numerosi vantaggi per il cuore: aiutano a ridurre i mediatori dell'infiammazione e lo stress ossidativo, contribuendo a stabilizzare le aritmie cardiache nei cani e a ridurre la pressione arteriosa e il rimodellamento cardiaco nelle cardiopatie.9-17
La cachessia cardiaca è comune nei cani con insufficienza cardiaca congestizia e la perdita di massa magra è associata a tempi di sopravvivenza significativamente più brevi.18–19 L'infiammazione sembra essere una delle cause che portano alla cachessia o un fattore che la favorisce. Pertanto, un altro vantaggio degli omega-3 è la riduzione degli effetti avversi derivanti dall'infiammazione sulla massa magra.20-22

Amminoacidi: taurina, lisina e metionina
La taurina è l'amminoacido più abbondante nel tessuto cardiaco. Sebbene il suo ruolo non sia ancora noto con precisione, gli studi dimostrano che è importante per mantenere la contrattilità del muscolo cardiaco e l'omeostasi.23–25 Nei gatti la taurina è un amminoacido essenziale, tuttavia una sua carenza può portare a insufficienza miocardica anche nei cani.26
La lisina e la metionina sono amminoacidi precursori della sintesi della carnitina, un peptide che contribuisce al trasporto degli acidi grassi a catena lunga nei mitocondri per la produzione di ATP.27

Vitamina E
Le specie reattive dell'ossigeno (ROS) sono il risultato del metabolismo cellulare. Tuttavia, se si accumulano, lo stress ossidativo aumenta, determinando danni alla membrana cellulare e al DNA, e denaturazione delle proteine. Le ROS in eccesso possono anche innescare una cascata di eventi molecolari che favoriscono le malattie cardiache. La vitamina E è un antiossidante cellulare in grado di individuare le ROS e contrastare i danni causati dallo stress ossidativo.
In condizioni di disfunzione mitocondriale, una condizione che favorisce l'insufficienza cardiaca, i livelli di ROS aumentano, incrementando il fabbisogno di antiossidanti.28-32

Magnesio
Il magnesio svolge diversi ruoli nel mantenimento di una funzionalità cardiaca corretta, incluse attività antiaritmiche e antiossidanti. Nelle cellule cardiache questo minerale contribuisce anche al trasporto dell'ATP. Negli esseri umani, livelli inadeguati di magnesio sono correlati all'insufficienza cardiaca e all'aumento del rischio di disturbi cardiovascolari.33-36
La ricerca di Purina

Un cuore che invecchia non sa più adattarsi ai disturbi o ai cambiamenti ambientali, come avviene in gioventù. Gli studi hanno dimostrato che l’incrementare di una particolare cascata molecolare, chiamata via di segnalazione Wnt/beta-catenina, rientra tra i molti effetti di un invecchiamento accelerato.37-39
Gli scienziati Purina hanno consultato i dati di espressione genica disponibili sull'invecchiamento del cuore.40, 41
Questo approccio computazionale ha messo in luce la sottoregolazione di quattro geni per la via di segnalazione Wnt nei cuori più anziani.
Tuttavia, l'intervento sulla dieta con limitazione delle calorie o aggiunta di un antiossidante (resveratrolo) ha ripristinato l'espressione genica ai livelli osservati nei cuori giovani.42-43
Questa ricerca ha dimostrato come la nutrizione possa influire positivamente a livello molecolare sull'invecchiamento cardiaco, conducendo a studi che hanno esplorato il modo in cui specifici nutrienti potrebbero supportare o migliorare la funzionalità cardiaca.
Aspetti chiave da ricordare
- I benefici di molte sostanze nutritive a supporto della salute del cuore sono riconosciuti.
- Gli acidi grassi sono la fonte primaria di ATP per i mitocondri cardiaci.
- Lo studio computazionale di Purina indica come la nutrizione possa avere un influsso positivo sull'invecchiamento cardiaco.
Esploriamo i fattori che trasformano la salute del cuore:
Ulteriori informazioni
- Doenst, T., Nguyen, T. D., & Abel, E. D. (2013). Cardiac metabolism in heart failure: implications beyond ATP production. Circulation Research, 113(6), 709–724.
- Lopaschuk, G.D., Ussher, J.R., Folmes, C.D., Jaswal, J.S., & Stanley, W.C. (2010). Myocardial fatty acid metabolism in health and disease. Physiological Reviews, 90(1), 207–258.
- Lopaschuk, G. (2017). Metabolic Modulators in Heart Disease: Past, Present, and Future. Canadian Journal of Cardiology, 33, 838–849.
- Labarthe, F., Gélinas, R., & Des Rosiers, C. (2008). Medium-chain fatty acids as metabolic therapy in cardiac disease. Cardiovascular Drugs and Therapy, 22(2), 97–106.
- Bach, A.C., & Babayan, V.K. (1982). Medium-chain triglycerides: an update. American Journal of Clinical Nutrition, 36(5), 950–962.
- Finck, B. N., Han, X., Courtois, M., Aimond, F., Nerbonne, J. M., Kovacs, A., Gross, R. W., & Kelly, D. P. (2003). A critical role for PPARalpha-mediated lipotoxicity in the pathogenesis of diabetic cardiomyopathy: modulation by dietary fat content. Proceedings of the National Academy of Sciences of the United States of America, 100(3), 1226–1231.
- Labarthe, F., Khairallah, M., Bouchard, B., Stanley, W.C., & Des Rosiers, C. (2005). Fatty acid oxidation and its impact on response of spontaneously hypertensive rat hearts to an adrenergic stress: benefits of a medium-chain fatty acid. American Journal of Physiology-Heart and Circulatory Physiology, 288(3), H1425–36.
- Saifudeen, I., Subhadra, L., Konnottil, R., & Nair, R. R. (2017). Metabolic Modulation by Medium-Chain Triglycerides Reduces Oxidative Stress and Ameliorates CD36-Mediated Cardiac Remodeling in Spontaneously Hypertensive Rat in the Initial and Established Stages of Hypertrophy. Journal of Cardiac Failure, 23(3), 240–251.
- Bauer, J.E. (2006). Metabolic basis for the essential nature of fatty acids and the unique dietary fatty acid requirements of cats. Journal of the American Veterinary Medical Association, 229(11), 1729–1732.
- Billman, G.E., Kang, J.X., & Leaf, A. (1999). Prevention of sudden cardiac death by dietary pure omega-3 polyunsaturated fatty acids in dogs. Circulation
,99(18), 2452–2457. - Freeman, L.M., Rush, J.E., Kehayias, J.J., Ross, J.N. Jr, Meydani, S.N., Brown, D.J., … Roubenoff, R. (1998). Nutritional alterations and the effect of fish oil supplementation in dogs with heart failure. Journal of Veterinary Internal Medicine, 12(6), 440–448.
- Freeman, L.M. (2010). Beneficial effects of omega-3 fatty acids in cardiovascular disease. Journal of Small Animal Practice, 51(9), 462–470.
- Laurent, G., Moe, G., Hu, X., Holub, B., Leong-Poi, H., Trogadis, J., Connelly, K., Courtman, D., Strauss, B. H., & Dorian, P. (2008). Long chain n-3 polyunsaturated fatty acids reduce atrial vulnerability in a novel canine pacing model. Cardiovascular Research, 77(1), 89–97.
- London, B., Albert, C., Anderson, M. E., Giles, W. R., Van Wagoner, D. R., Balk, E., … Lathrop, D. A. (2007). Omega-3 fatty acids and cardiac arrhythmias: prior studies and recommendations for future research: a report from the National Heart, Lung, and Blood Institute and Office Of Dietary Supplements Omega-3 Fatty Acids and their Role in Cardiac Arrhythmogenesis Workshop. Circulation, 116(10), e320–e335.
- Smith, C.E., Freeman, L.M., Rush, J.E., Cunningham, S.M., & Biourge, V. (2007). Omega-3 fatty acids in Boxer dogs with arrhythmogenic right ventricular cardiomyopathy. Journal of Veterinary Internal Medicine, 21(2), 265–273.
- Wall, R., Ross, R. P., Fitzgerald, G. F., & Stanton, C. (2010). Fatty acids from fish: the anti-inflammatory potential of long-chain omega-3 fatty acids. Nutrition Reviews, 68(5), 280–289.
- Hansen, R. A., Ogilvie, G. K., Davenport, D. J., Gross, K. L., Walton, J. A., Richardson, K. L., Mallinckrodt, C. H., Hand, M. S., & Fettman, M. J. (1998). Duration of effects of dietary fish oil supplementation on serum eicosapentaenoic acid and docosahexaenoic acid concentrations in dogs. American Journal of Veterinary Research, 59(7), 864–868.
- Ineson, D. L., Freeman, L. M., & Rush, J. E. (2019). Clinical and laboratory findings and survival time associated with cardiac cachexia in dogs with congestive heart failure. Journal of Veterinary Internal Medicine, 33(5), 1902–1908.
- Freeman, L.M. (2012). Cachexia and sarcopenia: emerging syndromes of importance in dogs and cats. Journal of Veterinary Internal Medicine, 26(1), 3–17.
- Dupont, J., Dedeyne, L., Dalle, S., Koppo, K., & Gielen, E. (2019). The role of omega-3 in the prevention and treatment of sarcopenia. Aging Clinical and Experimental Research, 31(6), 825–836.
- Gorjao, R., Dos Santos, C., Serdan, T., Diniz, V., Alba-Loureiro, T. C., Cury-Boaventura, M. F., Hatanaka, E., Levada-Pires, A. C., Sato, F. T., Pithon-Curi, T. C., Fernandes, L. C., Curi, R., & Hirabara, S. M. (2019). New insights on the regulation of cancer cachexia by N-3 polyunsaturated fatty acids. Pharmacology & Therapeutics, 196, 117–134.
- Robinson, S. M., Reginster, J. Y., Rizzoli, R., Shaw, S. C., Kanis, J. A., Bautmans, I., … Cooper, C., & ESCEO working group (2018). Does nutrition play a role in the prevention and management of sarcopenia? Clinical Nutrition (Edinburgh, Scotland), 37(4), 1121–1132.
- Sanderson S. L. (2006). Taurine and carnitine in canine cardiomyopathy. The Veterinary Clinics of North America. Small Animal Practice, 36(6), 1325–viii.
- Schaffer, S., Solodushko, V., & Azuma, J. (2000). Taurine-deficient cardiomyopathy: role of phospholipids, calcium and osmotic stress. Advances in Experimental Medicine and Biology, 483, 57–69.
- Schaffer, S. W., Jong, C. J., Ramila, K. C., & Azuma, J. (2010). Physiological roles of taurine in heart and muscle. Journal of biomedical science, 17, Suppl 1(Suppl 1), S2.
- Pion, P.D., Kittleson, M.D., Rogers, Q.R., & Morris, J.G. (1987). Myocardial Failure in Cats Associated with Low Plasma Taurine: A Reversible Cardiomyopathy. Science, 237, 764–768.
- Wang, Z., Liu, Y., Liu, G., Lu, H., Mao, C. (2018). L-Carnitine and heart disease. Life Sciences, 184, 88-97.
- Birringer, M., & Lorkowski, S. (2019). Vitamin E: regulatory role of metabolites. International Union of Biochemistry and Molecular Biology, Life, 71(4), 479–486.
- Michałek, M., Tabiś, A., Cepiel, A., & Noszczyk-Nowak, A. (2020). Antioxidative enzyme activity and total antioxidant capacity in serum of dogs with degenerative mitral valve disease. Canadian Journal of Veterinary Research, 84(1), 67–73.
- Pryor, W. A. (2000). Vitamin E and heart disease: basic science to clinical intervention trials. Free radical biology & medicine, 28(1), 141–164.
- Sagols, E., & Priymenko, N. (2011). Oxidative stress in dog with heart failure: the role of dietary fatty acids and antioxidants. Veterinary Medicine International, 2011, 180–206.
- Sozen, E., Demirel, T., & Ozer, N.K. (2019). Vitamin E: regulatory role in the cardiovascular system. International Union of Biochemistry and Molecular Biology Life, 71(4), 507–515.
- Del Gobbo, L.C., Imamura, F., Wu, J.H., de Oliveira Otto, M.C., Chiuve, S.E., & Mozaffarian, D. (2013). Circulating and dietary magnesium and risk of cardiovascular disease: a systematic review and meta-analysis of prospective studies. American Journal of Clinical Nutrition, 98(1), 160–173.
- Freeman, L.M., Rush, J.E., & Markwell, P.J. (2006). Effects of dietary modification in dogs with early chronic valvular disease. Journal of Veterinary Internal Medicine, 20, 1116–1126.
- Qu, X., Jin, F., Hao, Y., Li, H., Tang, T., Wang, H., Yan, W., & Dai, K. (2013). Magnesium and the risk of cardiovascular events: a meta-analysis of prospective cohort studies. PloS one, 8(3), e57720.
- Tardy, A.L., Pouteau, E., Marquez, D., Yilmaz, C., & Scholey, A. (2020). Vitamins and Minerals for Energy, Fatigue and Cognition: A Narrative Review of the Biochemical and Clinical Evidence. Nutrients, 12(1). pii: E228.
- Brack, A. S., Conboy, M. J., Roy, S., Lee, M., Kuo, C. J., Keller, C., & Rando, T. A. (2007). Increased Wnt signaling during aging alters muscle stem cell fate and increases fibrosis. Science (New York, N.Y.), 317(5839), 807–810.
- Liu, H., Fergusson, M. M., Castilho, R. M., Liu, J., Cao, L., Chen, J., … Finkel, T. (2007). Augmented Wnt signaling in a mammalian model of accelerated aging. Science (New York, N.Y.), 317(5839), 803–806.
- Marchand, A., Atassi, F., Gaaya, A., Leprince, P., Le Feuvre, C., Soubrier, F., Lompré, A. M., & Nadaud, S. (2011). The Wnt/beta-catenin pathway is activated during advanced arterial aging in humans. Aging Cell, 10(2), 220–232.
- Li, Q., & Hannah, S. S. (2012). Wnt/β-catenin signaling is downregulated but restored by nutrition interventions in the aged heart in mice. Archives of Gerontology and Geriatrics, 55(3), 749–754.
- Barger, J. L., Kayo, T., Vann, J. M., Arias, E. B., Wang, J., Hacker, T. A., Wang, Y., Raederstorff, D., … Prolla, T. A. (2008). A low dose of dietary resveratrol partially mimics caloric restriction and retards aging parameters in mice. PloS one, 3(6), e2264.