PREBIÓTICOS
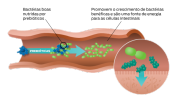
Os prebióticos são carboidratos dietéticos não digeríveis, como fibra e amido resistente, que servem como "alimento" para as bactérias intestinais benéficas.1
A definição formal de prebiótico é "um ingrediente fermentado seletivamente que permite mudanças específicas, tanto na composição quanto na atividade na microflora gastrointestinal que confere benefícios ao bem-estar e à saúde do hospedeiro".2 O objetivo final da suplementação com prebióticos é o aprimoramento da microbiota intestinal. No entanto, os prebióticos têm efeitos benéficos próprios, incluindo a melhoria da saúde do intestino em si.
INTESTINAL MICROVILLI
Características dos prebióticos
Todos os prebióticos conhecidos são carboidratos fermentáveis e não digeríveis. Os prebióticos facilitam mudanças específicas, tanto na composição quanto na atividade da microflora intestinal, que conferem benefícios ao bem-estar e saúde do hospedeiro.
Para ser considerado um prebiótico, um ingrediente alimentar deve:
- Resistir à digestão, à absorção e à quebra até chegar ao cólon
- Sofrer fermentação por microbioma no cólon
- Estimular seletivamente o crescimento somente das bactérias benéficas.2

A Purina usa inulina purificada, aleurona de trigo e raiz de chicória como prebióticos.
A inulina é extraída da raiz de chicória utilizando um processo com água quente e, por processamento adicional, a oligofrutose é extraída. Concentrações naturalmente altas de inulina também podem ser encontradas no alho, cebola, alcachofras e alho-poró.

A aleurona de trigo é encontrada como a única camada de células entre o farelo e o endosperma do grão de trigo.
A ciência por trás dos prebióticos

Cães e gatos não têm as enzimas necessárias para quebrar as ligações químicas de ingredientes prebióticos, como inulina e oligofrutose. No entanto, a microbiota no cólon dos animais de estimação tem a capacidade de quebrar essas ligações por meio da fermentação. A fermentação produz ácidos graxos de cadeia curta (SCFAs), como butirato, propionato e acetato, que reduzem o pH intestinal.
Este pH reduzido é responsável por muitos dos efeitos benéficos para saúde fornecidos pelos prebióticos. O ambiente ácido é desfavorável ao crescimento de bactérias patogênicas e também melhora a absorção de minerais dos alimentos que os animais de estimação consomem. Também nesse ambiente ácido, a amônia potencialmente prejudicial da digestão proteica é convertida em íons de amônio que são excretados imediatamente em vez de serem absorvidos para a desintoxicação no fígado e, em seguida, excretados na urina em forma de ureia. Esse processo pode desempenhar um papel útil em animais de estimação com função hepática ou renal diminuída.3a5
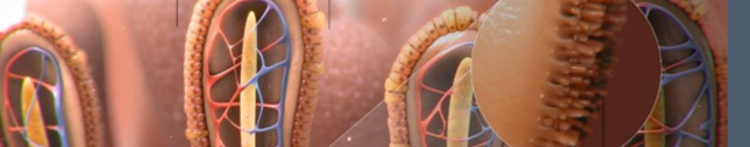
Os SCFAs também têm efeitos benéficos diretos nas células do intestino em si:
- O butirato é a principal fonte de energia para os colonócitos. Alimenta o cólon e resulta em aumento da espessura da mucosa intestinal, aumento da altura das vilosidades e melhora da profundidade da cripta6,7
- Essa área de superfície intestinal aumentada melhora a absorção de nutrientes
- O butirato tem propriedades anticarcinogênicas e anti-inflamatórias e pode melhorar a cicatrização do cólon em pessoascom doença inflamatória intestinal e colite ulcerativa.8
Pesquisa da Purina


Em um estudo de 9 anos, 77% dos gatos alimentados com prebióticos de chicória apresentaram aumento de bifidobactérias e lactobacilos (tipos benéficos de bactérias) e/ou diminuição de Clostridium perfringens (bactérias potencialmente patogênicas).15 No mesmo estudo, os gatos alimentados com uma mistura específica de nutrientes que incluía um prebiótico viveram em média de 1 ano a mais do que os gatos alimentados com a dieta de controle.
Olhando para o futuro, os prebióticos poderão ser usados como ferramenta para criar uma composição mais controlada ou ideal da microbiota intestinal, que poderá ser correlacionada com condições fisiológicas específicas para melhorar a saúde dos animais de estimação.
Principais pontos a serem lembrados
- Os prebióticos são carboidratos não digeríveis fermentados por bactérias benéficas no intestino.
- A Purina estudou os efeitos benéficos dos prebióticos, como a chicória, para a saúde intestinal.
- As alterações resultantes da fermentação, como a redução do pH intestinal e a produção de SCFAs, promovem a saúde intestinal.
- No futuro, os prebióticos poderão ser usados como ferramenta para criar composições mais favoráveis da microbiota intestinal.
Saiba mais
1. Valcheva, R., & Dieleman, L. A. (2016). Prebiotics: Definition and protective mechanisms. Best Practice & Research Clinical Gastroenterology, 30, 27–37.
2. Roberfroid, M. (2007). Prebiotics: The concept revisited. Journal of Nutrition, 173(3) Suppl. 2, 830S–837S.
3. Pinna, C., & Biagi, G. (2014). The utilization of prebiotics and synbiotics in dogs. Italian Journal of Animal Science, 13, 169–178.
4. Hesta, M., Janssens, G. P., Debraekeleer, J., & De Wilde, R. (2001). The effect of oligofructose and inulin on faecal characteristics and nutrient digestibility in healthy cats. Journal of Animal Physiology and Animal Nutrition (Berl), 85, 135–141.
5. Younes, H., Garleb, K., Behr, S., Rémésy, C., & Demigné, C. (1995). Fermentable fibers or oligosaccharides reduce urinary nitrogen excretion by increasing urea disposal in the rat cecum. Journal of Nutrition, 125, 1010–1016.
6. Buddington, R. K., & Sunvold, G. D. (1998). Fermentable fiber and the gastrointestinal tract ecosystem. Recent Advances in Canine and Feline Nutrition: 1998 Iams Nutrition Symposium Proceedings, pp. 449–461.
7. National Research Council (2006). Energy. In: Nutrient Requirements of Dogs and Cats. pp. 28–48. Washington DC: National Academies Press.
8. Knudsen, K., Serena, A., Canibe, N., & Juntunen, K. (2003). New insights into butyrate metabolism. Proceedings of the Nutrition Society, 62, 81–86.
9. Patil, A. R., Czarnecki-Maulden, G., & Dowling, K. E. (2000). Effect of advances in age on fecal microflora of cats. Federation of American Societies for Experimental Biology Journal, 14(4), A488.
10. Patil, A. R., Carrion, P. A., & Holmes, A. K. (2001). Effect of chicory supplementation on fecal microflora of cats. Federation of American Societies for Experimental Biology Journal, 15(4), A288.
11. Czarnecki-Maulden, G. L. (2001). Microflora and fiber in the GI tract: Helping the good guys. Veterinary Forum, 18(9), 43–45.
12. Czarnecki-Maulden, G. (2000). The use of prebiotics in prepared pet food. Veterinary International, 2(1), 19–23.
13. Czarnecki-Maulden, G. L., & Russell, T. J. (2000a). Effect of chicory on fecal microflora in dogs fed soy-containing or soy-free diets. Federation of American Societies for Experimental Biology Journal, 14(4), A488.
14. Czarnecki-Maulden, G. L., & Russell, T. J. (2000b). Effect of diet type on fecal microflora in dogs. Federation of American Societies for Experimental Biology Journal, 14(4), A488.
15. Cupp, C. J., Kerr, W. W., Jean-Phillipe, C., Patil, A. R., & Perez-Camargo, G. (2008). The role of nutritional interventions in the longevity and maintenance of long-term health in aging cats. International Journal of Applied Research in Veterinary Medicine, 6, 69–81.